Целью исследования является оценка ширины общей мягкой ткани (ST), уровня гребневой кости (CBL), контакта кости и имплантата (BIC) и плотности кости (BD) для циркониевых имплантатов с текстурированной микроканавками поверхностью и немедленной нагрузкой.
АВТОРЫ
- Рафаэль Арсесио Дельгадо-Руис, доктор, магистр наук, доктор наук;
- Хосе Луис Кальво-Гирадо, доктор, магистр наук, доктор наук;
- Маркус Аббуд, доктор, мастер наук, доктор наук;
- Мария Пьедад Рамирез-Фернандес, доктор, магистр наук, доктор наук;
- Хосе Эдуардо Мате-Санчес, доктор, магистр наук, доктор наук;
- Бруно Нери, доктор, магистр наук, доктор наук;
- Даниэль Ротамель, доктор, мастер наук, доктор наук
Цель: Целью исследования является оценка ширины общей мягкой ткани (ST), уровня гребневой кости (CBL), контакта кости и имплантата (BIC) и плотности кости (BD) для циркониевых имплантатов с текстурированной микроканавками поверхностью и немедленной нагрузкой.
Материалы и методы: в данной работе исследуется 51 имплантат; в каждой из исследуемых групп оставляли по одному имплантату для характеристики поверхности. Оставшиеся 48 имплантатов были в произвольном порядке установлены в области премоляров на обеих сторонах заживших адентичных нижних челюстей фоксхаундов. Они были разделены на три группы по 16: контрольную (титановые); экспериментальную А (из оксида циркония) и экспериментальную В (из оксида циркония с микроканавками). Имплантаты были шинированы и покрыты акриловым мостом. Использовался дизайн исследования по типу «split-mouth», и на одной стороне была применена немедленная нагрузка, в то время как у другой стороны не было окклюзионного контакта. ST, CBL, BIC и BD оценивались спустя 3 месяца. Было проанализировано влияние немедленной нагрузки на эти параметры.
Результаты: Все имплантаты остеоинтегрировались. К 3 месяцу ST установилась со средними параметрами в 2,9± 0,4 мм во всех группах. Не наблюдалось различий в отношении ST (р> 0,05) между сторонами с немедленной нагрузкой и без нее. CBL показал среднюю величину 1,2±0,3 мм для все групп без различий между стороной с нагрузкой и без нее (р> 0,05). BIC в процентном отношении был значительно выше у имплантатов с микроканавками и немедленной нагрузкой (р> 0,05). BD в процентном отношении была выше вокруг имплантатов с микроканавками (р> 0,05) и значительно выше у имплантатов с нагрузкой, чем у имплантатов без нагрузки.
Выводы: в пределах настоящего исследования можно сделать вывод, что при установке зубных имплантатов из оксида циркония с немедленной нагрузкой толщина ST остается стабильной, в результате чего образовавшаяся биологическая ширина в среднем составляет 3 мм; что сохранение гребневой кости связано с глубиной установки и что через 3 месяца после установки этих имплантатов и немедленной нагрузки можно ожидать более высокий процент BIC и повышенную BD вокруг имплантатов с микроканавками на всем внутрикостном участке.
КЛЮЧЕВЫЕ СЛОВА: BIC, плотность кости, сохранение гребневой кости, зубные имплантаты, гистоморфометрия, немедленная нагрузка, оксид циркония.
Введение
Несмотря на доказанную долговременную надежность титановых имплантов,1-4 сообщалось о некоторых недостатках как при краткосрочном, так и при долгосрочном использовании, в том числе и об аллергиях или чувствительности к титану, 5-8 о случаях уменьшения объема десны и прозрачности десны, из-за чего при тонком биотипе десны в эстетической зоне верхней челюсти был заметен темный/серый цвет титана, 9-14 и, наконец, электропроводности и коррозийных свойствах титана, которые в некоторых случаях могли повлиять на остеоинтеграцию.15,16
Эти факторы подтолкнули исследователей к изучению другие материалов для изготовления зубных имплантатов в качестве возможной альтернативы титану.
Керамические материалы из частично стабилизированного иттрием тетрагонального диоксида циркония, изготовленные под высоким давлением и при высоких температурах, значительно повышают механическую устойчивость к силам сжатия и разрушению.17-19 Эти материалы также обладают положительными оптическими качествами светопрозрачности, что является привлекательной характеристикой при изготовлении зубных имплантатов для эстетических зон,20 а также другими положительными свойства ми, например, отличной биосовместимостью, как при лабораторном 21, 22, так и при клиническом 23, 24 использовании, низкой бактериальной и патогенной адгезией, 25,26 и способностью к остеоинтеграции, сравнимойаналогичным свойством титана. 27,28
Для улучшения остеоинтеграции циркониевых имплантатов у экспериментальных имплантатов использовались различные модификации поверхности. В их числе: создание круглых отверстий туннельного типа в пластинчатых циркониевых имплантатах,29 воздушно-абразивная обработка поверхности имплантатов частицами различных размеров,30 обработка поверхности порообразующими веще ствами,31 обработка поверхности механическим путем или пескоструем с частицами оксида алюминия диаметром 250 мкм,32 обработка пескоструем в комбинации с травлением кислотой,33 применение порообразующих веществ для создания на поверхности пор разных размеров,34 нанометрические модификации,35,36 покрытие поверхности слоями оксида титана с образованием кальция,27 покрытия из биоактивной керамики24 или пескоструйная обработка с добавлением наноретейнеров. 37
Подобные модификации могут улучшить начальное заживление, сопротивление при отвинчивании и контакт кости и имплантата (BIC) и тем самым положительно повлиять на сохранение остеоинтеграции.
Гипотезу о том, что любая модификация поверхности циркониевого имплантата приведет к его повреждению, изучил Сильва с соавторами 38; они показали, что приложение силы в 600 Н к абатменту однокомпонентного керамического имплантата не повлияло на ожидаемый срок службы после 50000 циклов. Исследователи заключили, что неприживление имплантата зависит от величины нагрузки, прилагаемой на уровне внутреннего диаметра второй резьбы. Также проводились механические испытания частично полых и пористых циркониевых имплантатов, которые на основе оценки прочности при изгибе, прочности, трещиной кости и срока службы при усталостных нагрузках субстрата имплантата показали, что структурные свойства полых и пористых циркониевых имплантатов подходят под требования к структурным свойствам имплантатов. 39,40
Лазерная обработка циркониевых имплантатов могла бы решить проблему со снижением механических повреждений в результате обработки поверхности.
Недавно наша исследовательская команда модифицировала циркониевый имплантат, используя фемтосекундный лазер для создания микроканавок и микропор 30 мкм в диаметре на 2-мм участке шейки имплантата во внутрикостной части. В результате снизилось присутствие на поверхности таких загрязнителей, как А! и С, повысилось содержание кислорода, повысилась шероховатость поверхности, влияние на тетрагональную кристаллическую фазу отсутствовало, а поверхность была чистой и однородной. 41
Так как к настоящему моменту не опубликовано исследований об остеоинтеграции циркониевых имплантатов с микроканавками во внутрикостной части, настоящая работа является дальнейшим шагом в нашем продолжающемся исследовании клинического применения описанной выше модификации поверхности.
Следовательно, целью данной работы было испытание in vivo, с применением гистологического и морфометрического анализа, влияний дополнительных микроканавок на внутрикостной части циркониевых имплантатов, с количественной оценкой общей мягкой ткани (ST), потери гребневой кости (CBL), ВIС и плотности периферической кости (ВО), а также влияния на эти параметры немедленной нагрузки по сравнению с отсутствием нагрузок за 3 месяца.
МАТЕРИАЛЫ И МЕТОДЫ
В эксперименте использовались шесть фоксхаундов возрастом приблизительно 1 год, каждый весом 14-15 кг. Комитет по этике исследований на животных при Университете Мурисии в Испании одобрил протокол исследования, который соответствовал рекомендациям, установленным Директивой ЕС от 14 ноября 1986 (86/ 609/ЕЕС). Животных ежедневно кормили гранулированным кормом. Клинический осмотр определил, что общее состояние здоровья животных было хорошим, без системных заболеваний.
Хирургическая операция
Животные получили предварительную анестезию в виде 0,2-1,5 мг/кг ацепромазина за 10 минут до инъекции буторфанолом (0,2 мг/кг) и медетомидином (7 мг/кг). Смесь была введена внутримышечно в четырехглавую мышцу бедра. В головную вену был установлен катетер, затем через него вводился пропофол с медленной постоянной скоростью в 0,4 мг/кг/мин. В областях хирургического вмешательства была применена местная инфильтрационная анестезия. Эти процедуры проводились под наблюдением ветеринарного хирурга. Были удалены зубы с обеих сторон нижней челюсти (Р2, Р3, Р4 и Ml). Был выполнен внутриборозд ковый надрез от мезиальной поверхности Р2 к мезиальной поверхности М2, а также был откинут краевой лоскут размером 2 мм. Зубы были разрезаны в щечноязычном направлении до области бифуркации с помощью бора из карбида вольфрама; корни были удалены по отдельности с помощью периотома и щипцов, без повреждения костных стенок. Рана была зашита с помощью рассасывающихся швов (Dexon 3-0, Davis & Geck, American Cyanamid Со., Уэйн, штат Нью-Джерси, США).
Во время первой недели после операции животные получили антибиотики и анальгетики: амоксициллин (500 мг дважды в день) и ибупрофен (600 мг три раза в день) системным способом введения. На протяжении 14 дней после операции собак кормили мягким кормом, затем гранулированным.
Имплантаты
Характеристика поверхности. Бесконтактный интерферометрический микроскоп Veeko NT 1100® (Wyco Systems, Нью-Йорк, штат Нью-Йорк, США) применялся для количественной оценки параметров шероховатости поверхности. Из каждой группы было выбрано по одному имплантату для проведения анализа. При анализе в режиме вертикальной сканирующей интерферометрии использовалось увеличение х20,7, измерялись поверхности внутрикостной части имплантата на верхушке, по боковым сторонам и впадинам резьбы (для каждого имплантата проводилось 10 выбранных в произвольном порядке замеров в поперечном и вертикальном направлениях в каждой зоне). Затем были определены следующие параметры: среднее арифметическое значение абсолютных величин высоты поверхности на исследуемых участках (Sa), среднее расстояние между неровностями, пересекающими среднюю плоскость (Scx) и коэффициент площади неровной поверхности (Sdr).
Чтобы отделить шероховатость от волнистости и формы поверхности для проведения цифровых трехмерных измерений на микроме трическом уровне на участках в 290 х 290 мкм использовался фильтр верхних частот Гаусса с диапазоном волны 100 х 100 мкм.
Затем имплантаты были обезжирены в растворе этанола и высушены ацетоном. Для исследования топографии поверхности использовался растровый электронный микроскоп JEOL-6100 Qeol Ltd. Токио, Япония). Элементный анализ был путем энергодисперсионной рентгеновской спектроскопии с применением системы OXFORD INCA 300 (Oxford Instruments, Абингдон, Оксфордшир, Великобритания). Все образцы были покрыты тонким слоем токопроводящего углерода в устройстве для ионного распыления (устройство для ионного распыления SCD 004 с вспомогательным устройством ОСО 30, Ба!-Тес, Вадуц, Лихтенштейн, Германия). Элементный анализ проводился на десяти исследуемых участках одного размера на поверхности внутрикостной части имплантатов. Применялись следующие параметры наблюдения: фокусное расстояние в 32 мм, 20 кВ и 100-кратное увеличение.
Процедура установки имплантатов
Имплантаты устанавливали после двухмесячного периода заживления. После надреза альвеолярного гребня был откинут полнослойный лоскут, и каждый участок хирургического вмешательства был препарирован в соответствии с протоколом, рекомендованным производителем имплантатов (Bredent Medical®, GMBH & Со. KG, Зенден, Германия). Были подготовлены ложа имплантатов диаметром 4 мм и длиной 10 мм, каждое из них находилось на расстоянии 3-3,5 мм от соседнего отверстия. В обе половины нижней челюсти было установлено по 4 имплантата с винтовой резьбой, завинчивание проводилось с крутящим моментом 35 Нем, все имплантаты были одного размера и с одинаковой геометрией внутрикостной части. Тип и положение имплантата назначались в произвольном порядке с помощью специального программного обеспечения (Research Randomizer 3.0 с сайта www.randomizer.org).
Были установлены сорок восемь имплантатов диаметром 4 мм и длиной 10 мм, затем их разделили на три группы. Контрольная: 16 титановых имплантатов Blue-sky®, изготовленных из титана марки IV, с поверхностью, обработанной из пескоструя частицами оксида алюминия размером 350-550 мкм и протравленной путем погружения в ванну с 37% серной кислотой на 1 час (Bredent Medical®, GMBH & Со. KG); Экспериментальная А: 16 имплантатов White SKY, изготовленных из оксида циркония, с поверхностью, обработанной из пескоструя частицами оксида алюминия размером 350-550 мкм (Bredent Medical®, GMBH & Со. KG); Экспериментальная В: 16 циркониевых имплантатов White SKY, изготовленных из оксида циркония, с поверхностью, обработанной из пескоструя частицами оксида алюминия размером 350-550 мкм (Bredent Medical®, GMBH & Со. KG), а также с обработкой фемтосекундными лазерными импульсами для создания микроканавок шириной 30 мкм и длиной 70 мкм по всей внутрикостной поверхности с помощью вышеописанного метода.41
Для создания микроструктуры использовался коммерческий титан-сапфировый осциллятор (Tsunami, Spectra-Physics, Штансдорф, Германия) и система регенеративного усиления (Spitfire, Spectra-Physics) на основе технологии усиления чирпированного импульса. Система передает линейно поляризованные импульсы длительностью 120 фс на 795 нм с частотой повторения в 1 кГц. Поперечной модой была ТЕМОО, а ширина луча была 9 мм, максимальная энергия луча равнялась 1,1 кДж (рисунок 1).
Циркониевый имплантат был однокомпонентным, то есть включал в себя и абатмент, поэтому для создания аналогичных условий у имплантатов из Контрольной группы, с титановыми имплантатами использовались абатменты с механической обработкой SKY-EM00® (Bredent Medical GMBH & Со. KG), которые привинчивались к имплантатам с крутящим моментом 25 Нем.
Все абатменты имплантатов получили специально изготовленные из полиэфирэфиркетона () колпачки и затем были шиниро ваны с помощью 0,16 мм ортодонтической лигатуры и усилены с помощью акриловой смолы Pi-Ku-Plast36 (Bredent Meical GMBH & Со. KG). Применялся метод <>: к одной стороне прикладывалась немедленная окклюзионная нагрузка, при этом точки окклюзионных контактов определялись с помощью артикуляционной бумаги толщиной 100 мкм (Bausch Progress 100®, Dr.Jean Bausch KG, Кёльн, Германия) и открывающих-закрывающих движений челюсти, произведенных вручную; на другой стороне местоположение точек окклюзионного контакта было определено таким же методом, затем они были уменьшены и устранены, что позволило получить минимальное расстояние в 2 мм между акриловой шиной и противоположными зубами.

Рисунок 1. Изображения различных исследуемых имплантатов. У имплантатов одинаковая геометрия, но есть следующие различия: А, у титанового имплантата из контрольной группы есть микроспирали в области шейки; В у циркониевого имплантата из экспериментальной группы А поверхность обработана пескоструем; С у циркониевого импланта та из экспериментальной группы В поверхность обработана пескоструем и по всей внутрикостной поверхности идут микроканавки.
Все абатменты имплантатов получили специально изготовленные из полиэфирэфиркетона () колпачки и затем были шинированы с помощью 0,16 мм ортодонтической лигатуры и усилены с помощью акриловой смолы Pi-Ku-Plast36 (Bredent Meical GMBH & Со. KG). Применялся метод <>: к одной стороне прикладывалась немедленная окклюзионная нагрузка, при этом точки окклюзионных контактов определялись с помощью артикуляционной бумаги толщиной 100 мкм (Bausch Progress 100®, Dr.Jean Bausch KG, Кёльн, Германия) и открывающих-закрывающих движений челюсти, произведенных вручную; на другой стороне местоположение точек окклюзионного контакта было определено таким же методом, затем они были уменьшены и устранены, что позволило получить минимальное расстояние в 2 мм между акриловой шиной и противоположными зубами.
В первую неделю после операции животным давали антибиотики и анальгетик амоксициллин (500 мг дважды в день) и ибупрофен (600 мг трижды в день) системным способом введения. Швы сняли через 2 недели. Собаки получали мягкий корм на протяжении всего времени эксперимента для защиты временных акриловых шин от разрушения. Заживление оценивалось еженедельно, профилактика образования налета проводилась путем ополаскивания ротовой полости хлоргексидиндиглюконатом.
Гистологические и гистоморфометрические процедуры
Через три месяца после установки имплантатов животных усыпи ли путем передозировки пентотала Natrium® (Abbot Laboratories, Мадрид, Испания), затем для анализа путем резекции были изъяты блоки нижней челюсти. Образцы были зафиксированы в формальдегиде и обезвожены в серии этанолов с возрастающей до 100% концентрацией. Имплантаты и окружающая их костная ткань были погружены в метилметакрилат (Technovit 7100®, Heraeus Kulzer, Верхайм, Германия). Толстые гистологические срезы размером 100 мкм отрезались вдоль оси каждого имплантата в преддверно-язычном направлении с помощью систем для микросрезов с алмазной пилой (Exact-Apparatebau, Нордерштедт, Германия). Толщина данных срезов была уменьшена до 80 мкм с помощью шлифовальных техник. Из каждого имплантата было получено по три срединных среза. Применялось окрашивание толуидиновым синим. Были получены изображения срезов, затем срезы были проанализированы с помощью световой микроскопии (Olympus ВХ 61, Гамбург, Германия).
Гистоморфометрия
Гистоморфометрический анализ оценивал мягкие и твердые ткани. Оценка общего объема мягких тканей (ST) выполнялась путем измерения в миллиметрах расстояния между наиболее корональной стороной ST и наиболее корональным контактом кости и имплантата (ВIС). Уровень гребневой кости (CBL) оценивался путем измерения в миллиметрах расстояния от плеча имплантата в случае с циркониевыми имплантатам или от платформы в случае с титановыми до первой точки ВIС.
Для каждого гистологического среза BIC рассчитывался как определенная количественно длина контактирующей с костью поверхности имплантата по отношению к общей длине поверхности имплантата; соотношение выражалось в процентах.
Измерения плотности кости (BD) оценивали процентную долю минерализованной кости по отношению к процентной доле костномозговых полостей, которые измерялись и сравнивались на двух прямоугольных участках длиной 8 мм и шириной 1 мм, расположенных параллельно к оси тела имплантата. Первый из участков примыкал к имплантату (BDl), а второй участок такого же размера был на окружающей кости, взятой в качестве образца (BD2). Область BDl была определена путем размещения границы на концах резьбы параллельно продольной оси имплантата. Область BD2 была выбрана из параллельного участка материнской кости и находилась на расстоянии 500-1000 мкм от BDl, размеры областей совпадали.
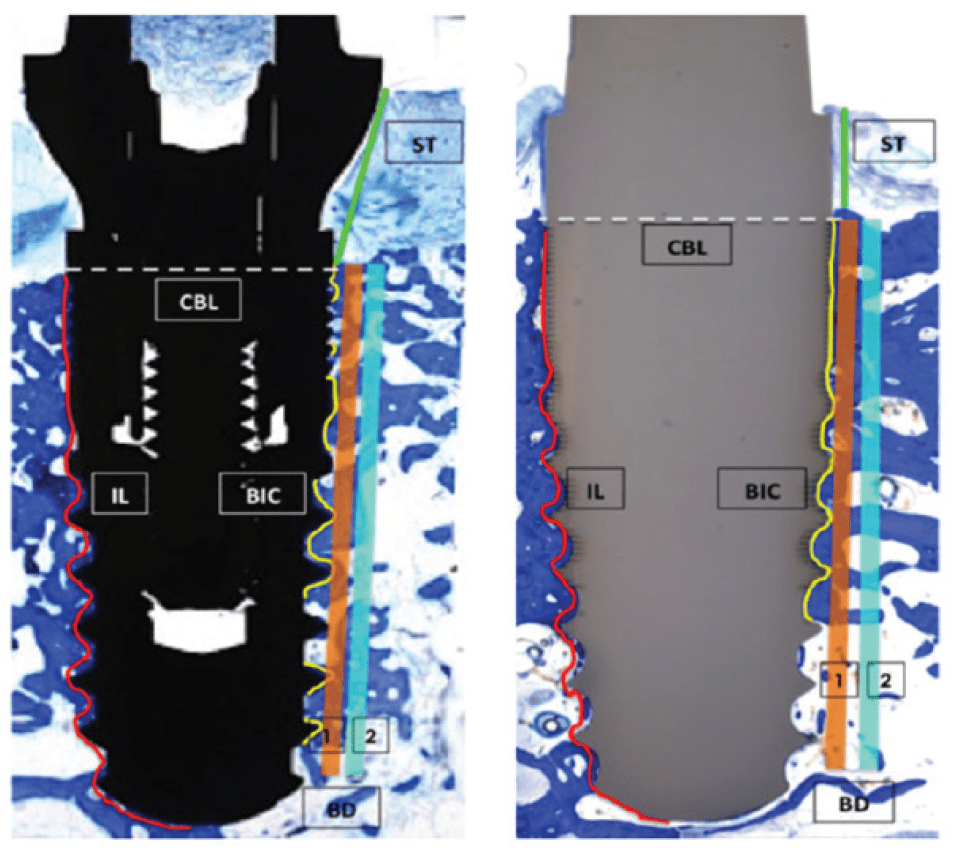
Рисунок 2. Ориентиры для rистоморфометрии. Титановый имплантат представлен в черном цвете. Циркониевый имплантат представлен в сером цвете. Белой пунктирной горизонтальной линией отмечен уровень погружения имплантата в кость, красной линией отмечена общая длина имплантата (IL), желтой линией отмечены области контакта кости и имплантата (BIC). Вертикальной оранжевой линией отмечена плотность кости (BD), прилегающей к имплантату (BDl), зеленой вертикальной линией отмечена плотность окружающей кости (BD2). ST, мяrкая ткань; CBL, уровень rребневой кости; IL, длина имплантата; BIC, контакт кости и имплантата; BD, плотность кости.
Гистоморфометрия проводилась с использованием видеокамеры (Sony 3CCD, Берлин, Германия) при увеличении х12,5 и х40. Изображения были отцифрованы (Axiophoto System, Carl Zeiss, Йена, Германия), затем были зафиксированы и измерены ориентиры (Рисунок 2).
Статистический анализ
Описательная статистика применялась для анализа гистоморфометрических данных ST, CBL, ВIС, BDl и BD2 (средние значения и стандартные отклонения); мезиальные и дистальные стороны каждого среза имплантата были усреднены до среднего значения.
Для статистической оценки изменений внутри групп применялся парный t-критерий; для сравнения между группами применялся непарный t-критерий. Погрешность была установлена на 0,05.
Для анализа в качестве единицы была принята собака (n=6), при этом использовались усредненные результаты имплантатов с одинаковой обработкой у одной и той же собаки, которые затем сравнивались.
РЕЗУЛЬТАТЫ
Характеристика поверхности
У имплантатов из экспериментальной группы В шероховатость поверхности, обозначенная как Sa, была в три раза выше, чем у экспериментальной группы , и в два раза выше, чем у контроль ной группы. У титановых имплантатов шероховатость поверхности была чуть более высокой, чем у имплантатов из экспериментальной группы А (Рисунок 3 и таблица 1).
Состав поверхности циркониевых имплантатов из экспериментальной группы А показал в основном ZrO2, а также углерод и алюминий; в экспериментальной группе В углерод и алюминий были обнаружены в меньших количествах. Поверхности имплантатов из контрольной группы в основном состояли из титана с небольшими следами углерода и алюминия, в TiO2 также присутствовал кислород. Никаких дополнительных элементов не обнаружилось (Таблица 2).

